Нейрофиламент - Neurofilament
| NF-L белок нейрофиламента с низким молекулярным весом | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | NEFL | ||||||
| Ген NCBI | 4747 | ||||||
| HGNC | 7739 | ||||||
| OMIM | 162280 | ||||||
| RefSeq | NM_006158 | ||||||
| UniProt | P07196 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 8 стр.21 | ||||||
| |||||||
| NF-M белок нейрофиламента средней молекулярной массы | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | NEFM | ||||||
| Альт. символы | NEF3 | ||||||
| Ген NCBI | 4741 | ||||||
| HGNC | 7734 | ||||||
| OMIM | 162250 | ||||||
| RefSeq | NM_005382 | ||||||
| UniProt | P07197 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 8 стр.21 | ||||||
| |||||||
| NF-H белок нейрофиламента с высоким молекулярным весом | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | NEFH | ||||||
| Ген NCBI | 4744 | ||||||
| HGNC | 7737 | ||||||
| OMIM | 162230 | ||||||
| RefSeq | NM_021076 | ||||||
| UniProt | P12036 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 22 q12.1-13.1 | ||||||
| |||||||
| Альфа-интернексин белок нейронального промежуточного филамента | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | В | ||||||
| Альт. символы | NEF5 | ||||||
| Ген NCBI | 9118 | ||||||
| HGNC | 6057 | ||||||
| OMIM | 605338 | ||||||
| RefSeq | NM_032727 | ||||||
| UniProt | Q5SYD2 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 10 q24 | ||||||
| |||||||
| Периферин нейрональный промежуточный филаментный белок | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | PRPH | ||||||
| Альт. символы | NEF4 | ||||||
| Ген NCBI | 5630 | ||||||
| HGNC | 9461 | ||||||
| OMIM | 170710 | ||||||
| RefSeq | NM_006262.3 | ||||||
| UniProt | P41219 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 12 q13.12 | ||||||
| |||||||
| Белок промежуточных филаментов нейрональных стволовых клеток нестин | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | РЭШ | ||||||
| Ген NCBI | 10763 | ||||||
| HGNC | 7756 | ||||||
| OMIM | 600915 | ||||||
| RefSeq | NP_006608 | ||||||
| UniProt | P48681 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 1 q23.1 | ||||||
| |||||||
Нейрофиламенты (NF) классифицируются как промежуточные филаменты типа IV найдено в цитоплазма из нейроны. Это белковые полимеры размером 10 нм в диаметре и многие микрометры в длину.[1] Вместе с микротрубочки (~ 25 нм) и микрофиламенты (7 нм) они образуют нейрональную цитоскелет. Считается, что они в первую очередь служат для обеспечения структурной поддержки аксоны и регулировать диаметр аксона, который влияет скорость нервной проводимости. Белки, образующие нейрофиламенты, являются членами семейства белков промежуточных филаментов, которое делится на шесть типов в зависимости от их генной организации и структуры белка. Типы I и II - это кератины которые выражаются в эпителиях. Тип III содержит белки виментин, десмин, периферин и глиальный фибриллярный кислый белок (GFAP). Тип IV состоит из белков нейрофиламентов L, M, H и интернексин. Тип V состоит из ядерные ламины, а тип VI состоит из белка нестин. Все гены промежуточных филаментов типа IV имеют два уникальных интроны не обнаружен в других последовательностях генов промежуточных филаментов, что предполагает общее эволюционное происхождение от одного примитивного гена типа IV.
Любая белковая нить, которая простирается в цитоплазме нервной клетки, также называется нейрофибрилла.[2] Это имя используется в нейрофибриллярные сплетения некоторых нейродегенеративные заболевания.
Белки нейрофиламентов
Белковый состав нейрофиламентов широко варьируется в зависимости от типа животных. Больше всего известно о нейрофиламентах млекопитающих. Исторически изначально считалось, что нейрофиламенты млекопитающих состоят всего из трех белков, называемых белком нейрофиламентов L (низкомолекулярный; НФЛ ), М (средняя молекулярная масса; NFM ) и H (высокомолекулярный; NFH ). Эти белки были обнаружены в результате исследований аксональный транспорт и их часто называют «триплетом нейрофиламентов».[3] Однако теперь ясно, что нейрофиламенты также содержат белок интернексин.[4] и что нейрофиламенты в периферической нервной системе также могут содержать белок периферин.[5] (это отличается от периферин 2 что выражается в сетчатка ). Таким образом, нейрофиламенты млекопитающих представляют собой гетерополимеры до пяти различных белков: NfL, NfM, NfH, интернексин-альфа и периферин. Пять белков нейрофиламентов могут совместно собираться в разных комбинациях в разных типах нервных клеток и на разных стадиях развития. Точный состав нейрофиламентов в любой данной нервной клетке зависит от относительных уровней экспрессии белков нейрофиламентов в клетке в это время. Например, экспрессия NfH низкая в развивающихся нейронах и увеличивается постнатально в нейронах с миелинизированными аксонами.[6] Во взрослой нервной системе нейрофиламенты в малых немиелинизированных аксонах содержат больше периферина и меньше NfH, тогда как нейрофиламенты в больших миелинизированных аксонах содержат больше NfH и меньше периферина. Субъединица промежуточного филамента III типа, виментин, экспрессируется в развивающихся нейронах и некоторых очень необычных нейронах у взрослых в ассоциации с белками типа IV, такими как горизонтальные нейроны из сетчатка.
| Протеин | Аминокислоты | NCBI Ref Seq | Прогнозируемая молекулярная масса | Кажущаяся молекулярная масса (SDS-PAGE) |
|---|---|---|---|---|
| Периферин | 470 | NP_006253.2 | 53,7 кДа | ~ 56 кДа |
| Интернексин | 499 | NP_116116.1 | 55,4 кДа | ~ 66 кДа |
| Белок нейрофиламента L | 543 | NP_006149.2 | 61,5 кДа | ~ 70 кДа |
| Белок нейрофиламента M | 916 | NP_005373.2 | 102,5 кДа | ~ 160 кДа |
| Белок нейрофиламента H | 1020 | NP_066554.2 | 111.9 кДА | ~ 200 кДа |
Триплетные белки названы в зависимости от их относительного размера (низкий, средний, высокий). Очевидное молекулярная масса каждого белка определяется SDS-СТРАНИЦА больше, чем масса, предсказанная из аминокислотной последовательности. Это происходит из-за аномальной электрофоретической миграции этих белков и особенно сильно проявляется для белков нейрофиламентов M и H из-за их высокого содержания заряженных аминокислот и обширного фосфорилирования. Все три триплетных белка нейрофиламентов содержат длинные участки полипептидной последовательности, богатой глютаминовая кислота и лизин остатков, а NfM и особенно NfH также содержат несколько тандемно повторяющихся серин сайты фосфорилирования. Почти все эти сайты содержат пептид лизин-серин-пролин (KSP), и фосфорилирование обычно обнаруживается на аксональных, а не дендритных нейрофиламентах. Человеческий NfM имеет 13 из этих сайтов KSP, тогда как человеческий NF-H экспрессируется из двух аллели один из которых дает 44, а другой 45 повторов KSP.
Сборка и структура нейрофиламента
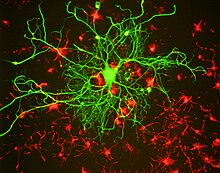
Как и другие белки промежуточных филаментов, белки нейрофиламентов имеют общую центральную альфа спиральный область, известная как стержневой домен из-за своей стержнеобразной третичной структуры, окруженной аминоконцевой и карбоксильный конец домены, которые в значительной степени неструктурированы. Палочковые домены двух белков нейрофиламентов димеризуются с образованием альфа-спиральной спиральная катушка. Два димера соединяются в шахматном порядке антипараллельно с образованием тетрамера. Этот тетрамер считается основной субъединицей (то есть строительным блоком) нейрофиламента. Субъединицы тетрамера связываются бок о бок с образованием нитей единичной длины, которые затем отжигаются встык с образованием зрелого полимера нейрофиламента, но точная организация этих субъединиц в полимере неизвестна, в основном из-за гетерогенного белка. состав и неспособность кристаллизовать нейрофиламенты или белки нейрофиламентов. Структурные модели обычно предполагают восемь тетрамеров (32 полипептида нейрофиламентов) в поперечном сечении филамента, но измерения линейной массовой плотности предполагают, что это может варьироваться.
Аминоконцевые домены белков нейрофиламентов содержат многочисленные сайты фосфорилирования и, по-видимому, важны для взаимодействий субъединиц во время сборки филаментов. Карбоксиконцевые домены, по-видимому, являются внутренне неупорядоченными доменами, в которых отсутствует альфа-спираль или бета-лист. Разные размеры белков нейрофиламентов в значительной степени обусловлены различиями в длине карбоксиконцевых доменов. Эти домены богаты кислотными и основными аминокислотными остатками. Карбоксиконцевые домены NFM и NFH являются самыми длинными и сильно модифицируются посттрансляционными модификациями, такими как фосфорилирование и гликозилирование in vivo. Они выступают радиально из основы волокна, образуя плотную щеточную границу из сильно заряженных и неструктурированных доменов, аналогичную щетине на щетке для бутылок. Эти энтропийно колеблющиеся домены были предложены для определения зоны исключения вокруг каждой нити, эффективно отделяя нити от их соседей. Таким образом, карбоксиконцевые выступы максимизируют заполняющие пространство свойства полимеров нейрофиламентов. Под электронной микроскопией эти домены выглядят как выступы, называемые боковыми ветвями, которые, кажется, контактируют с соседними нитями.

Функция нейрофиламента

Нейрофиламенты находятся в позвоночное животное нейроны в особенно высоких концентрациях в аксонах, где они все выровнены параллельно вдоль длинной оси аксона, образуя непрерывно перекрывающийся массив. Было предложено, чтобы они функционировали как структуры, заполняющие пространство, увеличивающие диаметр аксонов. Их вклад в диаметр аксона определяется количеством нейрофиламентов в аксоне и их плотностью упаковки. Считается, что количество нейрофиламентов в аксоне определяется экспрессией гена нейрофиламентов.[7] и аксональный транспорт. Плотность упаковки нитей определяется их боковыми сторонами, которые определяют расстояние между соседними нитями. Считается, что фосфорилирование боковых отростков увеличивает их растяжимость, увеличивая расстояние между соседними нитями.[8] за счет связывания двухвалентных катионов между боковыми сторонами соседних нитей[9][10]
На ранних стадиях развития аксоны представляют собой узкие отростки, содержащие относительно небольшое количество нейрофиламентов. Те аксоны, которые становятся миелинизированными, накапливают больше нейрофиламентов, что приводит к увеличению их калибра. После того, как аксон вырос и соединился со своим целевая ячейка диаметр аксона может увеличиться в пять раз.[11] Это вызвано увеличением количества нейрофиламентов, экспортируемых из тела нервных клеток, а также замедлением скорости их транспорта. В зрелых миелинизированных аксонах нейрофиламенты могут быть единственной наиболее распространенной цитоплазматической структурой и могут занимать большую часть площади поперечного сечения аксонов. Например, большой миелинизированный аксон может содержать тысячи нейрофиламентов в одном поперечном сечении.
Транспорт нейрофиламентов
Помимо своей структурной роли в аксонах, нейрофиламенты также являются грузом аксональный транспорт.[3] Большинство белков нейрофиламентов в аксонах синтезируются в теле нервных клеток, где они быстро собираются в полимеры нейрофиламентов в течение примерно 30 минут.[12] Эти собранные полимеры нейрофиламентов транспортируются вдоль аксона на микротрубочка треки питаются микротрубочкой моторные белки.[13] Нити движутся двунаправленно, то есть как к кончику аксона (антероградный), так и к телу клетки (ретроградный), но чистое направление антероградное. Волокна движутся со скоростью до 8 мкм / с в короткие промежутки времени (секунды или минуты) со средней скоростью примерно 1 мкм / с.[14] Однако средняя скорость в более длительных временных масштабах (часы или дни) медленная, потому что движения очень редки и состоят из коротких спринтов, прерываемых длинными паузами.[15][16] Таким образом, в долгосрочном масштабе нейрофиламенты перемещаются в медленном компоненте аксонального транспорта.
Клинические и исследовательские приложения
Многочисленные специфические антитела к нейрофиламентам были разработаны и коммерчески доступны белки. Эти антитела можно использовать для обнаружения белков нейрофиламентов в клетках и тканях с использованием иммунофлуоресценция микроскопия или иммуногистохимия. Такие антитела широко используются для идентификации нейронов и их отростков в гистологические срезы И в культура ткани. Нестин белка промежуточных филаментов типа VI экспрессируется в развивающихся нейронах и глии. Нестин считается маркером нейрональных стволовых клеток, и присутствие этого белка широко используется для определения нейрогенез. Этот белок теряется по мере развития.
Антитела к нейрофиламентам также широко используются в диагностике. невропатология. Окрашивание этими антителами позволяет отличить нейроны (положительные по белкам нейрофиламентов) от глия (отрицательный для белков нейрофиламентов).
Также значительный клинический интерес представляет использование белков нейрофиламентов в качестве биомаркеры аксонов при заболеваниях, поражающих центральную нервную систему[17][18] Когда нейроны или аксоны дегенерируют, белки нейрофиламентов попадают в кровь или спинномозговую жидкость. Таким образом, иммуноанализ белков нейрофиламентов в спинномозговой жидкости и плазме может служить индикатором повреждения аксонов при неврологических расстройствах.[19] NfL - полезный маркер для мониторинга заболеваний в боковой амиотрофический склероз,[20] рассеянный склероз,[21] и совсем недавно болезнь Хантингтона.[22] Он также оценивался как прогностический маркер функционального результата после острого ишемического инсульта.[23]
Мутант у мышей с аномалиями нейрофиламентов фенотипы напоминающий боковой амиотрофический склероз.[24]
Смотрите также
Рекомендации
- ^ Юань, А; Рао, М.В.; Veeranna; Никсон, РА (15 июля 2012 г.). «Нейрофиламенты с первого взгляда». Журнал клеточной науки. 125 (Pt 14): 3257–63. Дои:10.1242 / jcs.104729. ЧВК 3516374. PMID 22956720.
- ^ «Определение нейрофибриллы». www.merriam-webster.com. Получено 6 декабря 2019.
- ^ а б Хоффман П.Н., Ласек Р.Дж. (август 1975 г.). «Медленный компонент аксонального транспорта. Идентификация основных структурных полипептидов аксона и их общность среди нейронов млекопитающих». Журнал клеточной биологии. 66 (2): 351–66. Дои:10.1083 / jcb.66.2.351. ЧВК 2109569. PMID 49355.
- ^ Юань А., Рао М.В., Сасаки Т., Чен Ю., Кумар А., Лием Р.К. и др. (Сентябрь 2006 г.). «Альфа-интернексин структурно и функционально связан с белками триплета нейрофиламентов в зрелой ЦНС». Журнал неврологии. 26 (39): 10006–19. Дои:10.1523 / jneurosci.2580-06.2006. ЧВК 6674481. PMID 17005864.
- ^ Юань А., Сасаки Т., Кумар А., Петерхофф С.М., Рао М.В., Лием Р.К. и др. (Июнь 2012 г.). «Периферин - это субъединица нейрофиламентов периферических нервов: значение для дифференциальной уязвимости аксонов ЦНС и периферической нервной системы». Журнал неврологии. 32 (25): 8501–8. Дои:10.1523 / jneurosci.1081-12.2012. ЧВК 3405552. PMID 22723690.
- ^ Никсон Р.А., Ши ТБ (1992). «Динамика нейрональных промежуточных филаментов: перспективы развития». Подвижность клеток и цитоскелет. 22 (2): 81–91. Дои:10.1002 / см. 970220202. PMID 1633625.
- ^ Молекулярная биология клетки (4-е изд.). Наука о гирляндах. ISBN 978-0-8153-3218-3.
- ^ Эйер Дж., Летерье Дж. Ф. (июнь 1988 г.). «Влияние состояния фосфорилирования белков нейрофиламентов на взаимодействия между очищенными филаментами in vitro». Биохимический журнал. 252 (3): 655–60. Дои:10.1042 / bj2520655. ЧВК 1149198. PMID 2844152.
- ^ Кушкулей Дж., Чан В.К., Ли С., Эйер Дж., Летерье Дж. Ф., Летурнель Ф., Ши Т. Б. (октябрь 2009 г.). «Перекрестное связывание нейрофиламентов конкурирует с кинезин-зависимой ассоциацией нейрофиламентов с микротрубочками». Журнал клеточной науки. 122 (Pt 19): 3579–86. Дои:10.1242 / jcs.051318. PMID 19737816.
- ^ Кушкулей Дж., Меткар С., Чан В.К., Ли С., Ши ТБ (март 2010 г.). «Алюминий индуцирует агрегацию нейрофиламентов, стабилизируя перекрестное связывание фосфорилированных c-концевых боковых ветвей». Исследование мозга. 1322: 118–23. Дои:10.1016 / j.brainres.2010.01.075. PMID 20132798. S2CID 9615612.
- ^ Альбертс, Д. (2015). Молекулярная биология клетки (Шестое изд.). п. 947. ISBN 9780815344643.
- ^ Блэк М.М., Кейзер П., Собел Э. (апрель 1986 г.). «Интервал между синтезом и сборкой цитоскелетных белков в культивируемых нейронах». Журнал неврологии. 6 (4): 1004–12. Дои:10.1523 / JNEUROSCI.06-04-01004.1986. ЧВК 6568432. PMID 3084715.
- ^ Ван Л., Хо С.Л., Сан Д., Лием Р.К., Браун А. (март 2000 г.). «Быстрое движение аксональных нейрофиламентов, прерываемое длительными паузами». Природа клеточной биологии. 2 (3): 137–41. Дои:10.1038/35004008. PMID 10707083. S2CID 41152820.
- ^ Фенн Дж. Д., Джонсон К. М., Пэн Дж., Юнг П., Браун А. (январь 2018 г.). «Кимографический анализ с высоким временным разрешением раскрывает новые особенности кинетики транспорта нейрофиламентов». Цитоскелет. 75 (1): 22–41. Дои:10.1002 / см 21411. ЧВК 6005378. PMID 28926211.
- ^ Браун А (ноябрь 2000 г.). «Медленный аксональный транспорт: останови и уйди в аксон». Обзоры природы. Молекулярная клеточная биология. 1 (2): 153–6. Дои:10.1038/35040102. PMID 11253369. S2CID 205010517.
- ^ Браун А., Ван Л., Юнг П. (сентябрь 2005 г.). «Стохастическое моделирование транспорта нейрофиламентов в аксонах: гипотеза« стоп-энд-гоу »». Молекулярная биология клетки. 16 (9): 4243–55. Дои:10.1091 / mbc.E05-02-0141. ЧВК 1196334. PMID 16000374.
- ^ Петцольд А. (июнь 2005 г.). «Фосфоформы нейрофиламентов: суррогатные маркеры аксонального повреждения, дегенерации и потери» (PDF). Журнал неврологических наук. 233 (1–2): 183–98. Дои:10.1016 / j.jns.2005.03.015. PMID 15896809. S2CID 18311152.
- ^ Халил М., Теуниссен К.Э., Отто М., Пил Ф., Сормани М.П., Гаттрингер Т. и др. (Октябрь 2018 г.). «Нейрофиламенты как биомаркеры неврологических расстройств» (PDF). Обзоры природы. Неврология. 14 (10): 577–589. Дои:10.1038 / s41582-018-0058-z. PMID 30171200. S2CID 52140127.
- ^ Йонссон М., Зеттерберг Х., ван Страатен Э., Линд К., Сиверсен С., Эдман А. и др. (Март 2010 г.). «Биомаркеры цереброспинальной жидкости при поражениях белого вещества - результаты поперечного сечения исследования LADIS». Европейский журнал неврологии. 17 (3): 377–82. Дои:10.1111 / j.1468-1331.2009.02808.x. PMID 19845747. S2CID 31052853.
- ^ Розенгрен Л.Е., Карлссон Ю.Е., Карлссон Ю.О., Перссон Л.И., Виккелсо С. (ноябрь 1996 г.). «Пациенты с боковым амиотрофическим склерозом и другими нейродегенеративными заболеваниями имеют повышенные уровни белка нейрофиламентов в спинномозговой жидкости». Журнал нейрохимии. 67 (5): 2013–8. Дои:10.1046 / j.1471-4159.1996.67052013.x. PMID 8863508. S2CID 36897027.
- ^ Teunissen CE, Iacobaeus E, Khademi M, Brundin L, Norgren N, Koel-Simmelink MJ, et al. (Апрель 2009 г.). «Комбинация N-ацетиласпартата CSF и нейрофиламентов при рассеянном склерозе». Неврология. 72 (15): 1322–9. Дои:10.1212 / wnl.0b013e3181a0fe3f. PMID 19365053. S2CID 22681349.
- ^ Ниемеля В., Ландблом А.М., Бленнов К., Сундблом Дж. (27 февраля 2017 г.). «Тау или нейрофиламентный свет - какой биомаркер более подходящий для болезни Хантингтона?». PLOS ONE. 12 (2): e0172762. Дои:10.1371 / journal.pone.0172762. ЧВК 5328385. PMID 28241046.
- ^ Лю, Даошэнь; Чен, Цзин; Ван, Сюаньинг; Синь, Цзялунь; Цао, Жуйли; Лю, Чжижун (июнь 2020 г.). "Легкая цепь нейрофиламентов в сыворотке как прогностический биомаркер исхода ишемического инсульта: систематический обзор и метаанализ". Журнал инсульта и цереброваскулярных заболеваний. 29 (6): 104813. Дои:10.1016 / j.jstrokecerebrovasdis.2020.104813. PMID 32305278.
- ^ Лалонд Р., Стразиэль С. (2003). «Нейроповеденческие характеристики мышей с модифицированными генами промежуточных филаментов». Обзоры в неврологии. 14 (4): 369–85. Дои:10.1515 / REVNEURO.2003.14.4.369. PMID 14640321. S2CID 23675224.
