Влияние радиации на центральную нервную систему во время космического полета - Central nervous system effects from radiation exposure during spaceflight
Эта статья поднимает множество проблем. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны) (Узнайте, как и когда удалить этот шаблон сообщения)
|
Путешествие за пределы защитной атмосферы, магнитосферы и гравитационного поля Земли может нанести вред здоровью человека, и понимание такого вреда необходимо для успешного пилотируемого космического полета. Возможное воздействие на центральную нервную систему (ЦНС) особенно важно. Мощный наземный сотовый и модель животных Программа исследований поможет количественно оценить риск для ЦНС от воздействия космического излучения в будущих космических полетах на большие расстояния и будет способствовать разработке оптимизированных мер противодействия.
Возможные острые и поздние риски для ЦНС от галактические космические лучи (ГКЛ) и солнечные протонные события (СПС) являются документально подтвержденной заботой о человеческом исследовании наших Солнечная система.[1][2][3] В прошлом риски для ЦНС взрослых, которые подвергались воздействию низких и средних доз ионизирующего излучения (От 0 до 2 Гр (Серый) (Гр = 100 рад )) не были главным соображением. Однако тяжелый ионный компонент космической радиации представляет собой явные биофизические проблемы для клеток и тканей по сравнению с физическими проблемами, которые представляют земные формы радиации. Вскоре после открытия космических лучей беспокойство о рисках для ЦНС возникло в связи с предсказанием феномена световой вспышки, возникающего при прохождении одиночных ядер HZE через сетчатку;[4] это явление было подтверждено астронавтами "Аполлона" в 1970 и 1973 годах. Ядра HZE способны производить столб сильно поврежденных клеток или микроповреждения, на своем пути через ткани, что вызывает опасения по поводу серьезного воздействия на ЦНС.[5] В последние годы возникли другие проблемы с открытием нейрогенез и его влияние Ядра HZE, которые наблюдались в экспериментальных моделях ЦНС.
Человек эпидемиология используется в качестве основы для оценки риска для рак, острые радиационные риски, и катаракта. Однако этот подход не подходит для оценки риска для ЦНС от космического излучения. При дозах выше нескольких Гр пагубные изменения ЦНС возникают у людей, которых лечат радиация (например., гамма излучение и протоны ) от рака. Типичными являются лечебные дозы 50 Гр, что значительно превышает космическое облучение, даже если произойдет большой СПС. Таким образом, из четырех категорий радиационных рисков космического пространства (рак, ЦНС, дегенеративный, и острые лучевые синдромы ), доказательная база риска для ЦНС в наибольшей степени зависит от экспериментальных данных на животных. Понимание и снижение рисков для ЦНС требует активной исследовательской программы, которая будет опираться на базовые знания, полученные на клеточных и животных моделях, а также на разработку подходов к экстраполяции рисков и потенциальных преимуществ контрмер для космонавтов.
Несколько экспериментальных исследований, в которых используются пучки тяжелых ионов, моделирующих космическое излучение, дают конструктивные доказательства рисков для ЦНС, связанных с космическим излучением. Во-первых, воздействие ядер HZE в низких дозах (<50 сГр) значительно индуцирует нейрокогнитивный дефициты, такие как обучение и поведенческие изменения, а также оперант реакции у мышей и крыс. Облучение равными или более высокими дозами излучения с низкой ЛПЭ (например, гамма или же Рентгеновские лучи ) не показывают подобных эффектов. Порог потери производительности после воздействия ядер HZE зависит как от физических характеристик частиц, таких как линейная передача энергии (ЛПЭ), и возраст животного при воздействии. Было показано, что снижение производительности происходит при дозах, аналогичных тем, которые будут иметь место в миссии на Марс (<0,5 Гр). В нейрокогнитивный дефицит дофаминергический нервная система похожа на старение и, кажется, уникальна для космическое излучение. Во-вторых, воздействие HZE нарушает нейрогенез у мышей при низких дозах (<1 Гр), что свидетельствует о значительном дозозависимом снижении количества новых нейронов и олигодендроциты в субгранулярная зона (SGZ) гиппокампа зубчатые извилины. В третьих, активные формы кислорода (АФК) в нейронный клетки-предшественники возникают после воздействия ядер HZE и протонов в малых дозах и могут сохраняться в течение нескольких месяцев. Антиоксиданты и противовоспалительное средство агенты могут уменьшить эти изменения. В-четвертых, нейровоспаление возникает в ЦНС после воздействия ядер HZE и протонов. Кроме того, возрастные генетические изменения повышают чувствительность ЦНС к радиации.
Исследования на моделях животных, облученных ядрами HZE, показали, что важные изменения в ЦНС происходят с уровнями доз, которые вызывают озабоченность НАСА. Однако значение этих результатов для заболеваемости космонавтами не выяснено. Одна модель поздних тканевых эффектов [6] предполагает, что значительные эффекты будут происходить при более низких дозах, но с увеличенной задержкой. Следует отметить, что исследования, которые были проведены до настоящего времени, проводились на относительно небольшом количестве животных (<10 на группу); поэтому испытание эффектов пороговой дозы при более низких дозах (<0,5 Гр) в настоящее время не проводилось в достаточной степени. Поскольку проблема экстраполяции воздействия космической радиации на животных на людей станет проблемой для исследований космической радиации, такие исследования могут быть ограничены размером популяции, которая используется в исследованиях на животных. Более того, роль увеличения дозы до настоящего времени не изучена. Подход, позволяющий экстраполировать существующие наблюдения на возможные когнитивные изменения, снижение работоспособности или поздние воздействия на ЦНС у космонавтов, не был обнаружен. Новые подходы в системной биологии предлагают захватывающий инструмент для решения этой проблемы. Недавно было выявлено восемь пробелов для прогнозирования рисков ЦНС. Могут потребоваться исследования новых подходов к оценке риска для получения необходимых данных и знаний для разработки моделей проекции риска для ЦНС от космического излучения.
Острый и поздно радиационное повреждение центральная нервная система (ЦНС) может привести к изменениям в двигательная функция и поведение или же неврологические расстройства. Радиация и синергетические эффекты излучения с другими факторами космического полета могут повлиять на нервные ткани, что, в свою очередь, может привести к изменению функций или поведения. Для количественной оценки масштабов этого риска необходимо собрать данные, относящиеся к среде космического полета. Если это определено как риск достаточно высокой степени, следует использовать соответствующие стратегии защиты.
— Документ о требованиях к программе исследований человека, HRP-47052, Rev. C, от января 2009 г.[7]
Вступление
И GCR, и SPE представляют опасность для ЦНС. Основные ГКЛ состоят из протонов, α-частиц и частиц ядер HZE с широким энергетическим спектром от нескольких десятков до более 10 000 МэВ / нуклон. В межпланетном пространстве ожидается органная доза и эквивалент дозы ГКЛ более 0,2 Гр или 0,6 Зв в год соответственно.[8][9] Высокая энергия ГКЛ позволяет им проникать в любой материал на расстояние до сотен сантиметров, что исключает защиту от радиации как правдоподобную меру снижения рисков ГКЛ для ЦНС. Для SPE существует возможность получения поглощенной дозы более 1 Гр от SPE, если члены экипажа находятся в тонко экранированном космическом корабле или совершают выход в открытый космос.[10] Энергии СПС, хотя и значительны (от десятков до сотен МэВ), не исключают защиты от излучения в качестве потенциальной меры противодействия. Однако затраты на экранирование могут быть высокими для защиты от самых крупных событий.
В флюенс Количество заряженных частиц, попадающих в мозг космонавта, оценивалось несколько раз в прошлом.[11][12][13] По одной из оценок, во время трехлетней миссии на Марс при минимуме солнечной активности (с учетом спектра ГКЛ 1972 года) 20 миллионов из 43 миллионов клеток гиппокампа и 230 тысяч из 1,3 миллиона ядер клеток таламуса будут напрямую поражены одним или несколькими ядрами. частицы с зарядом Z> 15.[14][15] Эти числа не включают дополнительные попадания в клетки энергичных электронов (дельта-лучи), которые образуются вдоль трека ядер HZE. [13] или коррелированное клеточное повреждение.[16][17] Вклад дельта-лучей от GCR и коррелированного клеточного повреждения увеличивает количество поврежденных клеток в два-три раза по сравнению с оценками только первичного трека и представляет возможность гетерогенно поврежденных областей, соответственно. Важность такого дополнительного ущерба еще недостаточно изучена.
В настоящее время возможные вредные воздействия на ЦНС космонавта со стороны HZE-компонента GCR еще предстоит идентифицировать. Во многом это связано с отсутствием эпидемиологической базы для людей, с помощью которой можно было бы оценивать риски, и относительно небольшим количеством опубликованных экспериментальных исследований на животных. Факторы ОБЭ комбинируются с данными человека для оценки риска рака при облучении с низкой ЛПЭ. Поскольку этот подход невозможен для рисков ЦНС, потребуются новые подходы к оценке рисков. Таким образом, необходимы биологические исследования для установления уровней риска и моделей прогнозирования риска и, если уровни риска окажутся значительными, для разработки контрмер.
Описание рисков для центральной нервной системы, вызывающих озабоченность НАСА
Острые и поздние риски для ЦНС из-за космического излучения вызывают беспокойство при исследовательских миссиях на Луну или Марс. Острые риски для ЦНС включают: изменение когнитивной функции, снижение двигательной функции и изменения поведения, все из которых могут повлиять на работоспособность и здоровье человека. Поздние риски для ЦНС - это возможные неврологические расстройства, такие как болезнь Альцгеймера, деменция или преждевременное старение. Вызывает беспокойство эффект длительного воздействия на ЦНС низкой мощности дозы (<50 мГр / ч) протонов, частиц HZE и нейтронов соответствующих энергий для доз до 2 Гр.
Текущие допустимые пределы воздействия НАСА
PEL для краткосрочного и профессионального облучения космонавтов космической радиацией были одобрены главой НАСА по вопросам здравоохранения и медицины. PEL устанавливают требования и стандарты для проектирования миссий и выбора экипажа, как рекомендовано в NASA-STD-3001, том 1. НАСА использовало пределы дозы для риска рака и неканцерогенных рисков для BFO, кожи и линз с 1970 года. Планирование исследовательской миссии, предварительные пределы доз для риска ЦНС в значительной степени основаны на экспериментальных результатах с моделями животных. Однако необходимы дальнейшие исследования для подтверждения и количественной оценки этих рисков, а также для уточнения значений пределов доз. PEL ЦНС, которые соответствуют дозам в области мозга, называемой гиппокампом, устанавливаются для периодов времени 30 дней или 1 год или для карьеры со значениями 500, 1000 и 1500 мГр-экв соответственно. Хотя используется единица измерения мГр-экв, ОБЭ для воздействия на ЦНС в значительной степени неизвестно; поэтому рекомендуется использовать функцию фактора качества для оценки риска рака. Для частиц с зарядом Z> 10 дополнительное требование PEL ограничивает физическую дозу (мГр) в течение 1 года и карьеры до 100 и 250 мГр соответственно. НАСА использует компьютеризированные модели анатомической геометрии для оценки самозащиты тела в гиппокампе.
Свидетельство
Обзор человеческих данных
Доказательства воздействия наземных форм ионизирующего излучения на ЦНС были задокументированы у пациентов, получающих лучевую терапию, хотя доза для этих пациентов выше, чем у космонавтов в космической среде. Поведенческие изменения со стороны ЦНС, такие как хроническая усталость и депрессия, происходят у пациентов, которые проходят курс облучения для лечения рака.[18] Нейрокогнитивные эффекты, особенно у детей, наблюдаются при более низких дозах облучения.[19][20] Недавний обзор интеллекта и успеваемости детей после лечения опухолей головного мозга показывает, что радиационное облучение связано со снижением интеллекта и академической успеваемости, включая низкий коэффициент интеллекта (IQ), вербальные способности и IQ производительности; успеваемость по чтению, правописанию и математике; и функционирование внимания.[21] Умственная отсталость наблюдалась у детей, переживших атомную бомбардировку в Японии, которые подверглись внутриутробному облучению в умеренных дозах (<2 Гр) через 8–15 недель после зачатия, но не в более ранние или более поздние пренатальные периоды.[20]
Лучевая терапия для лечения нескольких опухолей с помощью протонов и других пучков заряженных частиц обеспечивает дополнительные данные для рассмотрения радиационных эффектов для ЦНС. Отчет NCRP № 153 [3] отмечает использование заряженных частиц «для лечения опухолей гипофиза,[22][23] гормонально-зависимая метастатическая карцинома молочной железы,[24] опухоли головного мозга,[25][26] и внутричерепные артериовенозные мальформации и другие цереброваскулярные заболевания.[27][28][29][30][31][32]В этих исследованиях обнаруживаются ассоциации с неврологическими осложнениями, такими как нарушения когнитивного функционирования, овладения языком, визуально-пространственными способностями, памятью и исполнительными функциями, а также изменениями в социальном поведении. Подобные эффекты не проявлялись у пациентов, получавших химиотерапию. Во всех этих примерах пациенты получали чрезвычайно высокие дозы, которые были ниже порога некроза.[33][34] Поскольку когнитивные функции и память тесно связаны с белым объемом головного мозга префронтальной / лобной доли и поясной извилиной, дефекты нейрогенеза могут играть решающую роль в нейрокогнитивных проблемах у облученных пациентов.[3]
Обзор вопросов космического полета
Первое предположение о влиянии космического излучения на ЦНС было сделано Корнелиусом Тобиасом в его 1952 году, описав феномен световой вспышки, вызванный прохождением одиночных ядер HZE через сетчатку.[35] Вспышки света, такие как описанные Тобиасом, наблюдались астронавтами во время первых миссий Аполлона, а также в специальных экспериментах, которые впоследствии проводились в миссиях Аполлон и Скайлаб.[36] Совсем недавно исследования световых вспышек проводились на российской космической станции "Мир" и МКС.[37] В отчете НАН за 1973 г. эти эффекты рассматривались подробно. Это явление, известное как Фосфен, это визуальное восприятие мерцающего света. Это считается субъективным ощущением света, так как оно может быть вызвано простым давлением на глазное яблоко.[3] Было установлено, что прохождение одиночной сильно заряженной частицы через затылочную кору или сетчатку могло вызвать световую вспышку. Возможные механизмы световых вспышек, вызванных HZE, включают направленную ионизацию и излучение Черенкова в сетчатке.[2]
Наблюдение космонавтами вспышек света привлекло внимание к возможному влиянию ядер HZE на функцию мозга. В микроповреждения Концепция, которая рассматривала эффекты колонки поврежденных клеток, окружающих путь ядра HZE, пересекающего критические области мозга, возникла в это время.[2][5] Важной задачей, которая все еще остается, является определение того, вносят ли и в какой степени такие пересечения частиц вклад в функциональную деградацию в ЦНС.
Возможное наблюдение эффектов ЦНС у астронавтов, которые участвовали в прошлых миссиях НАСА, маловероятно по нескольким причинам. Во-первых, продолжительность прошлых миссий относительно коротка, а количество космонавтов невелико. Во-вторых, когда астронавты путешествуют на НОО, они частично защищены магнитным полем и твердым телом Земли, что вместе снижает мощность дозы ГКЛ примерно на две трети от ее значений в свободном пространстве. Кроме того, ГКЛ на НОО имеет более низкие компоненты ЛПЭ по сравнению с ГКЛ, которые будут встречаться при переходе к Марсу или на поверхности Луны, потому что магнитное поле Земли отталкивает ядра с энергиями ниже примерно 1000 МэВ / нуклон, которые имеют выше LET. По этим причинам риски для ЦНС являются более серьезной проблемой для длительных лунных миссий или для миссии на Марс, чем для миссий на МКС.
Радиобиологические исследования рисков центральной нервной системы для протонов, нейтронов и ядер с высоким Z и высокой энергией
И GCR, и SPE могут способствовать возникновению острых и поздних рисков для ЦНС для здоровья и работоспособности астронавтов. В этом разделе представлено описание исследований, которые были выполнены по влиянию космической радиации на модели клеток, тканей и животных.
Воздействие на нейрональные клетки и центральную нервную систему
Нейрогенез
ЦНС состоит из нейронов, астроцитов и олигодендроцитов, которые образуются из мультипотентных стволовых клеток. Отчет NCRP № 153 представляет собой превосходное и краткое введение в состав и типы клеток, представляющих интерес для радиационных исследований ЦНС:[3] «ЦНС состоит из нейронов, заметно различающихся по размеру и количеству на единицу площади. Есть несколько ядер или центров, которые состоят из плотно упакованных тел нейронных клеток (например, дыхательный и сердечный центры в дне четвертого желудочка). В коре головного мозга крупные тела нейронных клеток, такие как клетки Беца, разделены значительным расстоянием. Дополнительное значение имеют нейроглия, которая является опорными клетками и состоит из астроцитов, олигодендроглии и микроглии. Эти клетки проникают и поддерживают нервную ткань ЦНС, связывая ее вместе, как каркас, который также поддерживает сосудистую сеть. Самыми многочисленными из нейроглии являются астроциты I типа, которые составляют примерно половину мозга, что значительно превышает количество нейронов. Нейроглия сохраняет способность к делению клеток, в отличие от нейронов, и, следовательно, ответы на излучение различаются между типами клеток. Третий тип ткани в головном мозге - это сосудистая сеть, которая проявляет сопоставимую уязвимость к радиационным повреждениям с тканями, обнаруженными в других частях тела.[38] Радиационно-индуцированное повреждение олигодендроцитов и эндотелиальных клеток сосудистой сети составляет основные аспекты патогенеза повреждения головного мозга, которое может возникнуть после высоких доз излучения с низкой ЛПЭ ». На основании исследований с излучением с низкой ЛПЭ ЦНС считается радиоустойчивой тканью. Например: при лучевой терапии ранние мозговые осложнения у взрослых обычно не развиваются, если ежедневные фракции 2 Гр или менее вводятся с общей дозой до 50 Гр.[3] Допустимая доза в ЦНС, как и в других тканях, зависит от объема и конкретного анатомического местоположения облучаемого мозга человека.[19]
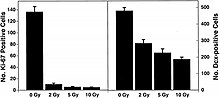
В последние годы исследования стволовых клеток показали, что нейрогенез все еще происходит в гиппокампе взрослых, где определяются когнитивные действия, такие как память и обучение.[39][40] Это открытие обеспечивает подход к механистическому пониманию риска космического излучения для ЦНС. Накапливающиеся данные показывают, что излучение влияет не только на дифференцированные нервные клетки, но также на пролиферацию и дифференцировку клеток-предшественников нейронов и даже стволовых клеток взрослых. Недавние данные указывают на то, что клетки-предшественники нейронов чувствительны к радиации.[18][41][42] Исследования излучения с низкой ЛПЭ показывают, что излучение останавливает не только образование нейрональных клеток-предшественников, но также их дифференциацию в нейроны и другие нервные клетки. Отчет NCRP № 153 [3] отмечает, что клетки в SGZ зубчатой извилины подвергаются дозозависимому апоптозу при облучении рентгеновскими лучами более 2 Гр, а производство новых нейронов у молодых взрослых самцов мышей значительно снижается при относительно низких (> 2 Гр) дозах рентгеновского излучения. . Отчет NCRP № 153 [3] также отмечает, что: «Наблюдается, что эти изменения зависят от дозы. Напротив, не наблюдалось явных эффектов на продукцию новых астроцитов или олигодендроцитов. Измерения активированной микроглии показали, что изменения нейрогенеза были связаны со значительной дозозависимой воспалительной реакцией даже через 2 месяца после облучения. Это говорит о том, что патогенез давно признанного когнитивного повреждения, вызванного радиацией, может включать потерю нервных клеток-предшественников из SGZ зубчатой извилины гиппокампа и изменения нейрогенеза ».
Недавние исследования свидетельствуют о патогенезе ядер HZE в ЦНС.[43][44][45][46] Авторы одного из этих исследований [44] были первыми, кто предположил нейродегенерацию с ядрами HZE, как показано на рисунке 6-1 (а). Эти исследования демонстрируют, что излучение HZE привело к прогрессирующей потере нейрональных клеток-предшественников в SGZ в дозах от 1 до 3 Гр в зависимости от дозы. Отчет NCRP № 153 [3] отмечает, что «Мышей облучали от 1 до 3 Гр ионов 12C или 56Fe, и через 9 месяцев были определены количественно пролиферирующие клетки и незрелые нейроны в зубчатой SGZ. Результаты показали, что уменьшение количества этих клеток зависело от дозы и ЛПЭ. Потеря клеток-предшественников также была связана с измененным нейрогенезом и устойчивым воспалительным ответом, как показано на рисунках 6-1 (а) и 6-1 (b). Эти результаты показывают, что излучение с высокой ЛПЭ оказывает значительный и длительный эффект на нейрогенную популяцию в гиппокампе, который включает потерю клеток и изменения в микросреде. Работа подтверждена другими исследованиями.[43][44] Эти исследователи отметили, что эти изменения согласуются с изменениями, обнаруженными у пожилых людей, что указывает на то, что облучение тяжелыми частицами является возможной моделью для изучения старения ».
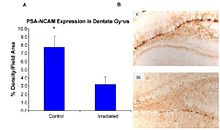
Окислительное повреждение
Недавние исследования показывают, что клетки-предшественники нейронов взрослых крыс из гиппокампа демонстрируют острый дозозависимый апоптотический ответ, который сопровождается увеличением ROS.[47] Протоны с низкой ЛПЭ также используются в клинической лучевой терапии протонным пучком при ОБЭ 1,1 по сравнению с мегавольтным рентгеновским излучением при высокой дозе. Отчет NCRP № 153 [3] отмечает, что: «Относительные уровни АФК были увеличены почти при всех дозах (от 1 до 10 Гр) протонов Брэгговского пика 250 МэВ в периоды времени после облучения (от 6 до 24 часов) по сравнению с необлученными контролями.[48] Увеличение ROS после протонного облучения было более быстрым, чем наблюдаемое с помощью рентгеновских лучей, и показало четко выраженную дозовую реакцию через 6 и 24 часа, увеличиваясь примерно в 10 раз по сравнению с контролем со скоростью 3% на Гр. Однако через 48 часов после облучения уровни ROS упали ниже контрольных и совпали с незначительным снижением содержания митохондрий. Было показано, что использование антиоксидантной альфа-липоевой кислоты (до или после облучения) устраняет вызванное облучением повышение уровней ROS. Эти результаты подтверждают более ранние исследования с использованием рентгеновских лучей и предоставляют дополнительные доказательства того, что повышенные ROS являются неотъемлемой частью радиоактивного ответа нервных клеток-предшественников ». Кроме того, излучение с высокой ЛПЭ привело к значительно более высоким уровням окислительного стресса в клетках-предшественниках гиппокампа по сравнению с излучением с более низкой ЛПЭ (рентгеновские лучи, протоны) при более низких дозах (≤1 Гр) (рис. 6-2). Использование антиоксидантной липоевой кислоты позволило снизить уровни ROS ниже фоновых уровней при добавлении до или после облучения ионами 56Fe. Эти результаты убедительно показывают, что низкие дозы ионов 56Fe могут вызывать значительные уровни окислительного стресса в нейронных клетках-предшественниках при низких дозах.
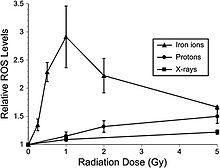
Нейровоспаление
Нейровоспаление, которое является основной реакцией на повреждение головного мозга, характеризуется активацией резидентной микроглии и астроцитов и локальной экспрессией широкого спектра медиаторов воспаления. Острое и хроническое нейровоспаление изучалось в мозге мышей после воздействия HZE. Острый эффект HZE проявляется при 6 и 9 Гр; нет исследований при более низких дозах. Рекрутирование миелоидных клеток происходит через 6 месяцев после воздействия. Расчетное значение ОБЭ облучения HZE для индукции острого нейровоспалительного ответа равно трем по сравнению с таковым при гамма-облучении.[46] Пути ЦОГ-2 вовлечены в нейровоспалительные процессы, которые вызваны излучением с низкой ЛПЭ. Повышающая регуляция ЦОГ-2 в облученных клетках микроглии приводит к выработке простагландина E2, который, по-видимому, ответственен за радиационно-индуцированный глиоз (избыточное распространение астроцитов в поврежденных областях ЦНС).[50][51][52]
Поведенческие эффекты
Поскольку поведенческие эффекты трудно измерить количественно, они, следовательно, являются одним из самых неопределенных рисков космической радиации. Отчет NCRP № 153 [3] отмечает, что: «Литература по поведенческой нейробиологии изобилует примерами основных различий в поведенческих результатах в зависимости от вида животных, линии или используемого метода измерения. Например, по сравнению с необлученными контрольными мышами, мыши, подвергшиеся рентгеновскому облучению, демонстрируют зависящие от гиппокампа пространственное обучение и нарушения памяти в лабиринте Барнса, но не в водном лабиринте Морриса. [53] что, однако, может быть использовано для демонстрации дефицита у крыс.[54][55] Исследования поведения излучения частиц проводились на крысах и мышах, но с некоторыми различиями в результатах в зависимости от измеренной конечной точки ».
Следующие исследования предоставляют доказательства того, что космическое излучение влияет на поведение ЦНС животных в определенной степени в зависимости от дозы и ЛПЭ.
Сенсомоторные эффекты
Сенсомоторный дефицит и нейрохимические изменения наблюдались у крыс, подвергшихся воздействию низких доз ионов 56Fe.[56][57] Дозы ниже 1 Гр снижают эффективность, что подтверждается испытанием на проволочной подвеске. Изменения поведения наблюдались уже через 3 дня после лучевого воздействия и продолжались до 8 месяцев.Биохимические исследования показали, что вызванное K + высвобождение дофамина было значительно снижено в группе облученных вместе с изменением нервных сигнальных путей.[58] Об отрицательном результате сообщили Pecaut et al.,[59] в котором не наблюдались поведенческие эффекты у самок мышей C57 / BL6 в течение периода от 2 до 8 недель после воздействия на них 0, 0,1, 0,5 или 2 Гр ускоренных ионов 56Fe (1 ГэВ / u56Fe), измеренных в открытом поле. , ротород или привыкание к акустическому испугу.
Радиационные изменения условного вкусового отвращения
Есть данные, что дефицит условного отвращения вкуса (CTA) вызывается низкими дозами тяжелых ионов.[60][61][62][63][64] Тест CTA - это классическая парадигма обусловливания, которая оценивает поведение избегания, которое возникает, когда прием нормально приемлемого продукта питания связан с болезнью. Это считается стандартным поведенческим тестом на токсичность лекарства.[65] Отчет NCRP № 153 [3] отмечает, что: «Роль дофаминергической системы в радиационно-индуцированных изменениях СТА подтверждается тем фактом, что на СТА, вызванную амфетамином, которая зависит от дофаминергической системы, действует радиация, тогда как на СТА, индуцированную хлоридом лития, которая не действует. вовлекает дофаминергическую систему, не подвергается воздействию радиации. Было установлено, что степень CTA из-за излучения зависит от ЛПЭ ([рисунок 6-3]) и что ионы 56Fe являются наиболее эффективными из различных типов излучения с низкой и высокой ЛПЭ, которые были протестированы.[61][62] Похоже, что дозы всего ~ 0,2 Гр ионов 56Fe влияют на CTA ».
ОБЭ различных типов тяжелых частиц на функцию ЦНС и когнитивные / поведенческие функции изучали на крысах Sprague-Dawley.[66] Взаимосвязь между пороговыми значениями для индуцированного частицами HZE нарушения обучения CTA, индуцированного амфетамином, показано на рисунке 6-4; а для нарушения реакции операнта показано на рисунке 6-5. Эти рисунки показывают аналогичную картину реакции на разрушительные эффекты воздействия частиц 56Fe или 28Si как на обучение CTA, так и на реакцию оперантов. Эти результаты предполагают, что ОБЭ различных частиц при нейроповеденческой дисфункции нельзя предсказать исключительно на основе ЛПЭ конкретной частицы.



Влияние излучения на оперантное кондиционирование
Оперантное обусловливание использует несколько последствий для изменения произвольного поведения. Недавние исследования Rabin et al.[67] исследовали способность крыс выполнять оперантный приказ для получения подкрепления пищей, используя график восходящего фиксированного соотношения (FR). Они обнаружили, что 56Дозы ионов Fe, превышающие 2 Гр, влияют на адекватную реакцию крыс на возрастающие требования к работе. Отчет NCRP № 153 [3] отмечает, что «нарушение оперантного ответа у крыс было испытано через 5 и 8 месяцев после воздействия, но было показано, что поддержание крыс на диете, содержащей экстракт клубники, но не черники, предотвращает нарушение.[68] При тестировании через 13 и 18 месяцев после облучения не было обнаружено различий в производительности между облученными крысами, которые содержались на контрольной, клубничной или черничной диете. Эти наблюдения предполагают, что положительный эффект антиоксидантных диет может зависеть от возраста ».
Пространственное обучение и память
Эффекты воздействия ядер HZE на пространственное обучение, поведение памяти и нейронную передачу сигналов были протестированы, и пороговые дозы также были рассмотрены для таких эффектов. Будет важно понять механизмы, которые участвуют в этих дефицитах, чтобы экстраполировать результаты на другие режимы доз, типы частиц и, в конечном итоге, космонавтов. Исследования на крысах проводились с использованием теста водного лабиринта Морриса через 1 месяц после облучения всего тела 1,5 Гр при 1 ГэВ / ед. 56Fe-ионы. Облученные крысы демонстрировали когнитивные нарушения, аналогичные наблюдаемым у старых крыс. Это приводит к возможности того, что увеличение количества АФК может быть ответственно за индукцию когнитивных нарушений, связанных как с радиацией, так и с возрастом.[55]
Отчет NCRP № 153 [3] отмечает, что: «Денисова и др. подвергали крыс воздействию 1,5 Гр 1 ГэВ / мкФион и проверяли их пространственную память в восьмилучевом радиальном лабиринте. Облучение привело к ухудшению когнитивного поведения крыс, поскольку они совершали больше ошибок, чем контрольные крысы в радиальном лабиринте, и не могли принять пространственную стратегию для решения лабиринта.[69] Чтобы определить, связаны ли эти результаты со специфическими изменениями чувствительности к окислительному стрессу, воспалению или пластичностью нейронов в отдельных областях мозга, три области мозга, полосатое тело, гиппокамп и лобная кора, которые связаны с поведением, были изолированы и сравнены с контрольной группой. Облученные подверглись неблагоприятному воздействию, что отражалось в уровнях дихлорфлуоресцеина, теплового шока и синаптических белков (например, синаптобревина и синаптофизина). Изменения этих факторов, следовательно, изменяли клеточную сигнализацию (например, кальций-зависимую протеинкиназу С и протеинкиназу А). Эти изменения в ответах мозга существенно коррелировали с ошибками рабочей памяти в радиальном лабиринте. Результаты показывают различную чувствительность, зависящую от области мозга, вызванную облучением 56Fe ([рисунок 6-6]). Эти результаты аналогичны тем, которые наблюдаются у старых крыс, предполагая, что повышенный окислительный стресс и воспаление могут быть ответственны за индукцию как радиации, так и возрастного когнитивного дефицита ».

Острые риски для центральной нервной системы
В дополнение к возможным изменениям характеристик в полете и двигательных навыков, которые были описаны выше, непосредственными эффектами на ЦНС (то есть в течение 24 часов после воздействия излучения с низкой ЛПЭ) являются анорексия и тошнота.[70] Эти продромальные риски зависят от дозы и, как таковые, могут служить индикатором дозы облучения. Оценки: ED50 = 1,08 Гр для анорексии, ED50 = 1,58 Гр для тошноты и ED50 = 2,40 Гр для рвоты. Относительная эффективность различных типов радиации при возникновении рвоты изучалась на хорьках и показана на рис. 6-7. Излучение с высокой ЛПЭ при дозах ниже 0,5 Гр демонстрирует более высокую относительную биологическую эффективность по сравнению с излучением с низкой ЛПЭ.[63] Острое воздействие на ЦНС, связанное с увеличением количества цитокинов и хемокинов, может привести к нарушению пролиферации стволовых клеток или потере памяти, что может способствовать развитию других дегенеративных заболеваний.

Компьютерные модели и системно-биологический анализ рисков для центральной нервной системы
Поскольку эпидемиология человека и экспериментальные данные о рисках для ЦНС от космического излучения ограничены, модели млекопитающих являются важными инструментами для понимания неопределенностей рисков для человека. Клеточные, тканевые и генетические модели животных использовались в биологических исследованиях ЦНС с использованием имитации космического излучения. Новые технологии, такие как трехмерные культуры клеток, микроматрицы, протеомика и визуализация мозга, используются в систематических исследованиях рисков для ЦНС от различных типов излучения. Согласно биологическим данным, математические модели могут быть использованы для оценки рисков космической радиации.
Подходы системной биологии к болезни Альцгеймера, которые рассматривают биохимические пути, которые играют важную роль в развитии заболевания ЦНС, были разработаны исследованиями, финансируемыми вне НАСА. На рис. 6-8 схематически показаны биохимические пути, которые играют важную роль в развитии болезни Альцгеймера. Описание взаимодействия космической радиации в рамках этих путей могло бы стать одним из подходов к разработке моделей прогнозирования рисков космической радиации. Например, если бы пути, которые изучались на животных моделях, можно было коррелировать с исследованиями на людях, страдающих болезнью Альцгеймера, можно было бы применить подход к описанию риска, который использует биохимические степени свободы. Эдельштейн-Кешет и Спирос [71] разработали in silico модель сенильных бляшек, связанных с болезнью Альцгеймера. В этой модели биохимические взаимодействия между TNF, IL-1B и IL-6 описаны в нескольких важных популяциях клеток, включая астроциты, микроглию и нейроны. Кроме того, в этой модели растворимый амилоид вызывает хемотаксис микроглии и активирует секрецию IL-1B. На рис. 6-9 показаны результаты модели Эдельштейна-Кешета и Спироса, моделирующей образование бляшек и гибель нейронов. Установление связи между изменениями, вызванными космическим излучением, и изменениями, описанными в этом подходе, может быть использовано для разработки in silico модель болезни Альцгеймера, вызванной космическим излучением.
Рисунок 6-8.Молекулярные пути важны при болезни Альцгеймера. Из Киотской энциклопедии генов и геномов. Изображение, защищенное авторским правом, находится по адресу http://www.genome.jp/kegg/pathway/hsa/hsa05010.html

Другими интересными путями-кандидатами, которые могут быть важны в регуляции индуцированных радиацией дегенеративных изменений ЦНС, являются пути передачи сигналов, которые регулируются с помощью Cdk5. Cdk5 - киназа, играющая ключевую роль в нервном развитии; его аберрантная экспрессия и активация связаны с нейродегенеративными процессами, включая болезнь Альцгеймера.[72][73] Эта киназа активируется в нервных клетках после воздействия ионизирующего излучения.[74]
Риски в контексте сценариев работы геологоразведочных миссий
Прогнозы для космических полетов
На основании имеющихся данных невозможно сделать надежные прогнозы рисков ЦНС для космических полетов. Исследования поведения животных показывают, что излучение с высоким HZE имеет высокий ОБЭ, но данные не согласуются. К другим факторам неопределенности относятся: возраст облучения, качество излучения и влияние мощности дозы, а также вопросы, касающиеся генетической предрасположенности к риску для ЦНС от воздействия космического излучения. Прежде чем можно будет оценить риск для ЦНС, необходимы дополнительные исследования.
Возможность применения биологических контрмер
Цель исследований космической радиации состоит в оценке и уменьшении неопределенностей в моделях прогнозирования рисков и, при необходимости, в разработке контрмер и технологий для мониторинга и лечения неблагоприятных последствий для здоровья и производительности человека, которые имеют отношение к космической радиации для краткосрочного и профессионального облучения. включая острые или поздние эффекты ЦНС от радиационного воздействия. Необходимость разработки мер противодействия рискам для ЦНС зависит от дальнейшего понимания рисков для ЦНС, особенно вопросов, связанных с возможным пороговым значением дозы, и если да, то какие миссии НАСА, вероятно, превысят пороговые дозы. В результате экспериментальных исследований на животных ожидается, что антиоксиданты и противовоспалительные средства будут эффективными мерами противодействия риску воздействия космической радиации на ЦНС.[68] Было показано, что диета из черники и клубники снижает риски для ЦНС после воздействия тяжелых ионов. Оценка эффектов диеты и пищевых добавок будет основной целью исследований ЦНС по контрмерам.
Диета, богатая фруктами и овощами, значительно снижает риск некоторых заболеваний. Ретиноиды и витамины A, C и E, вероятно, являются наиболее известными и изученными естественными радиопротекторами, но также гормоны (например, мелатонин), глутатион, супероксиддисмутаза и фитохимические вещества из растительных экстрактов (включая зеленый чай и овощи семейства крестоцветных). Поскольку металлы (особенно соли селена, цинка и меди) также изучаются в качестве пищевых добавок для людей, в том числе космонавтов, которые подверглись чрезмерному облучению.[75] Антиоксиданты должны обеспечивать пониженную защиту или отсутствие защиты от начального повреждения от плотно ионизирующего излучения, такого как ядра HZE, потому что прямой эффект более важен, чем опосредованное свободными радикалами непрямое радиационное повреждение при высокой ЛПЭ. Однако ожидается, что некоторые преимущества должны проявиться при стойком окислительном повреждении, связанном с воспалением и иммунными реакциями.[76] Некоторые недавние эксперименты показывают, что, по крайней мере, для острого облучения в высоких дозах, может быть достигнута эффективная радиозащита с помощью пищевых добавок, даже в случае облучения с высокой ЛПЭ. Хотя есть доказательства того, что диетические антиоксиданты (особенно клубника) могут защитить ЦНС от пагубного воздействия высоких доз частиц HZE,[68] поскольку механизмы биологических эффектов при низких мощностях доз отличаются от механизмов острого облучения, потребуются новые исследования длительных воздействий, чтобы понять потенциальные преимущества биологических контрмер.
Обеспокоенность потенциальным пагубным воздействием антиоксидантов было поднято недавним метаисследованием эффектов антиоксидантных добавок в рационе здоровых людей.[77] Авторы этого исследования не нашли статистически значимых доказательств того, что антиоксидантные добавки положительно влияют на смертность. Напротив, они пришли к выводу, что β-каротин, витамин A и витамин E, по-видимому, увеличивают риск смерти. Есть опасения, что антиоксиданты могут позволить спасти клетки, которые все еще выдерживают мутации ДНК или измененные паттерны метилирования генома после радиационного повреждения ДНК, что может привести к нестабильности генома. Подход к поврежденным клеткам-мишеням для апоптоза может быть выгодным при хроническом воздействии GCR.
Индивидуальные факторы риска
Потенциально важными индивидуальными факторами являются генетические факторы, предшествующее радиационное облучение и предыдущая травма головы, например сотрясение мозга. Было показано, что аполипопротеин E (ApoE) является важным и распространенным фактором в ответах ЦНС. ApoE контролирует перераспределение липидов между клетками и экспрессируется на высоком уровне в головном мозге.[78] Новые исследования рассматривают влияние космической радиации на основные изоформы ApoE, которые кодируются различными аллелями (ε2, ε3 и ε4). Было показано, что изоформа ApoE ε4 увеличивает риск когнитивных нарушений и снижает возраст для болезни Альцгеймера. Неизвестно, одинаково ли взаимодействие радиационной чувствительности или других индивидуальных факторов риска для излучения с высокой и низкой ЛПЭ. Другие изоформы ApoE повышают риск других заболеваний. Люди, у которых есть хотя бы одна копия аллеля ApoE ε4, подвержены повышенному риску атеросклероза, который также считается повышенным риском из-за радиации. Люди, у которых есть две копии аллеля ApoE ε2, подвержены риску заболевания, известного как гиперлипопротеинемия III типа. Поэтому будет чрезвычайно сложно рассматривать генетические факторы в парадигме множественного радиационного риска.
Вывод
В настоящее время невозможно сделать надежные прогнозы рисков для ЦНС от воздействия космического излучения из-за нехватки данных по этому вопросу. Существующие данные о животных и клетках действительно предполагают, что космическое излучение может вызывать неврологические и поведенческие эффекты; следовательно, это может повлиять на работу миссии. Однако значение этих результатов в отношении заболеваемости космонавтами не выяснено. Следует отметить, что к настоящему времени исследования проводились на относительно небольшом количестве животных (<10 на группу); это означает, что испытание эффектов пороговой дозы при более низких дозах (<0,5 Гр) еще не проводилось в достаточной степени. Поскольку проблема экстраполяции воздействия космической радиации на животных на человека станет проблемой для исследований космической радиации, такие исследования могут быть ограничены размером популяции, которая обычно используется в исследованиях на животных. Более того, роль увеличения дозы до настоящего времени не изучена. Не был обнаружен подход, позволяющий экстраполировать существующие наблюдения на возможные когнитивные изменения, снижение работоспособности или поздние воздействия на ЦНС у космонавтов. Для получения данных и знаний, необходимых для разработки моделей прогнозирования риска для ЦНС от космического излучения, могут потребоваться исследования новых подходов к оценке риска. Активная программа исследований, которая потребуется для решения этих проблем, должна опираться на новые подходы к оценке рисков и проверке контрмер из-за отсутствия полезных данных по радиоэпидемиологии человека в этой области.
Смотрите также
Рекомендации
- ^ NAS / NRC, Целевая группа по биологическим эффектам космической радиации, Совет по космическим наукам (1996). Радиационная опасность для экипажей межпланетных миссий. Вашингтон, округ Колумбия: Национальная академия прессы. Дои:10.17226/5540. ISBN 978-0-309-05698-4.
- ^ а б c НАН (1973). HZE-частицы в пилотируемом космическом полете. Вашингтон, округ Колумбия: NAS.
- ^ а б c d е ж грамм час я j k л м п NCRP, Отчет NCRP № 153 (2006). Информация, необходимая для выработки рекомендаций по радиационной защите для космических полетов за пределами низкой околоземной орбиты. Бетесда, Мэриленд: NCRP. Архивировано из оригинал на 2015-06-10.
- ^ Тобиас, Калифорния (август 1952 г.). «Радиационная опасность в высотной авиации». Журнал авиационной медицины. 23 (4): 345–72. PMID 12980897.
- ^ а б Тодд, П. (1989). «Стохиастика микроповреждений, вызванных HZE». Adv. Space Res. 9 (10): 31–34. Bibcode:1989AdSpR ... 9 ... 31T. Дои:10.1016/0273-1177(89)90420-1. PMID 11537310.
- ^ Рубин, П; Casarett, GW (1968). Клиническая лучевая патология, Vol. II. Филадельфия, Пенсильвания: У. Б. Сондерс. ISBN 978-0721677903.
- ^ Палоски, В. «Документ с требованиями программы исследований человека» (PDF). НАСА. Архивировано из оригинал (PDF) на 2009 год.
- ^ Cucinotta, FA; Wu, H; Бритвы, MR; Джордж, К. (июнь 2003 г.). «Радиационная дозиметрия и биофизические модели воздействия космической радиации». Бюллетень гравитационной и космической биологии: публикация Американского общества гравитационной и космической биологии. 16 (2): 11–8. PMID 12959127.
- ^ Cucinotta, FA; Дюранте, М. (май 2006 г.). «Риск рака от воздействия галактических космических лучей: последствия для исследования космоса людьми». Ланцет онкологии. 7 (5): 431–5. Дои:10.1016 / S1470-2045 (06) 70695-7. PMID 16648048.
- ^ Ким, MH; Cucinotta, FA; Уилсон, Дж. В. (июнь 2007 г.). «Временной прогноз радиационной обстановки для будущих космических миссий». Радиационная и экологическая биофизика. 46 (2): 95–100. Дои:10.1007 / s00411-006-0080-1. PMID 17165049. S2CID 40723431.
- ^ Крейвен, Пенсильвания; Райкрофт, MJ (октябрь 1994). «Потоки ядер галактического железа и связанных вторичных HZE и результирующие дозы облучения в мозгу космонавта». Успехи в космических исследованиях. 14 (10): 873–8. Bibcode:1994AdSpR..14..873C. Дои:10.1016/0273-1177(94)90552-5. PMID 11540033.
- ^ Curtis, SB; Letaw, JR; Силерберг, Р. (1989). «Галактические космические лучи и частоты попадания в клетки вне магнитосферы». Успехи в космических исследованиях. 9 (10): 293–8. Bibcode:1989AdSpR ... 9..293C. Дои:10.1016/0273-1177(89)90452-3. PMID 11537306.
- ^ а б Cucinotta, FA; Nikjoo, H; Гудхед, Д. Т. (июль 1998 г.). «Влияние дельта-лучей на количество пересечений треков частиц на ячейку в лабораторных и космических экспозициях». Радиационные исследования. 150 (1): 115–9. Bibcode:1998РадР..150..115С. Дои:10.2307/3579651. JSTOR 3579651. PMID 9650608.
- ^ Curtis, SB; Васкес, Мэн; Уилсон, JW; Этвелл, Вт; Ким, М; Капала, Дж (1998). «Частоты попадания космических лучей в критические участки центральной нервной системы». Успехи в космических исследованиях. 22 (2): 197–207. Bibcode:1998AdSpR..22..197C. Дои:10.1016 / S0273-1177 (98) 80011-2. PMID 11541397.
- ^ Curtis, SB; Васкес, Мэн; Уилсон, JW; Этвелл, Вт; Ким, MH (2000). «Космические лучи попадают в центральную нервную систему на максимуме солнечной активности». Успехи в космических исследованиях. 25 (10): 2035–40. Bibcode:2000AdSpR..25.2035C. Дои:10.1016 / s0273-1177 (99) 01015-7. HDL:2060/20040110269. PMID 11542854.
- ^ Cucinotta, FA; Nikjoo, H; Гудхед, Д. Т. (июль 1999 г.). «Применение моделей аморфных треков в радиационной биологии». Радиационная и экологическая биофизика. 38 (2): 81–92. Дои:10.1007 / s004110050142. PMID 10461753. S2CID 9148453.
- ^ Пономарев А, Кучинотта Ф.А. (2006). «Ядерная фрагментация и количество треков частиц в ткани». Radiat. Защищать. Досим. 122 (104): 354–361. Дои:10.1093 / rpd / ncl465. PMID 17261538.
- ^ а б Tofilon, PJ; Файк, младший (апрель 2000 г.). «Радиоотклик центральной нервной системы: динамический процесс». Радиационные исследования. 153 (4): 357–70. Дои:10.1667 / 0033-7587 (2000) 153 [0357: trotcn] 2.0.co; 2. PMID 10798963.
- ^ а б Schultheiss, TE; Kun, LE; Ang, KK; Стивенс, LC (30 марта 1995 г.). «Лучевая реакция центральной нервной системы». Международный журнал радиационной онкологии, биологии, физики. 31 (5): 1093–112. Дои:10.1016/0360-3016(94)00655-5. PMID 7677836.
- ^ а б BEIR-V, Национальный исследовательский совет (1990). Последствия для здоровья воздействия низких уровней ионизирующего излучения. Вашингтон, округ Колумбия: Национальная академия прессы. Дои:10.17226/1224. ISBN 978-0-309-03995-6. PMID 25032334.
- ^ Батлер, RW; Хазер, Дж. К. (2006). «Нейрокогнитивные эффекты лечения рака у детей». Обзоры исследований в области умственной отсталости и пороков развития. 12 (3): 184–91. Дои:10.1002 / mrdd.20110. PMID 17061287.
- ^ Kjellberg, RN; Климан, Б. (1979). «Пожизненная эффективность: система терапии аденом гипофиза с акцентом на протонную гипофизэктомию по Брэггу». В Linfoot, JA (ред.). Последние достижения в диагностике и лечении опухолей гипофиза. Нью-Йорк: Raven Press. С. 269–288.
- ^ Линфут, Дж. А. (1979). «Тяжелая ионная терапия: альфа-терапия опухолей гипофиза». Последние достижения в диагностике и лечении опухолей гипофиза. Нью-Йорк: Raven Press. С. 245–267.
- ^ Тобиас, Калифорния (1979). «Излучение гипофиза: радиационная физика и биология». В Linfoot, JA (ред.). Последние достижения в диагностике и лечении опухолей гипофиза. Нью-Йорк: Raven Press. С. 221–243.
- ^ Кастро, младший; Чен, GT; Блейкли, EA (1985). «Текущие соображения в области лучевой терапии с тяжелыми заряженными частицами: клинические исследования лаборатории Лоуренса Беркли Калифорнийского университета, онкологической группы Северной Калифорнии и онкологической группы лучевой терапии». Радиационные исследования. Добавка. 8: S263–71. Дои:10.2307/3583536. JSTOR 3583536. PMID 3937173.
- ^ Костюм, H; Гойтейн, М; Munzenrider, J; Верхей, L; Блитцер, П; Gragoudas, E; Koehler, AM; Ури, М; Джентри, Р; Шипли, Вт; Урано, М; Даттенхейвер, Дж; Вагнер, М. (декабрь 1982 г.). «Оценка клинической применимости протонных пучков в окончательной фракционированной лучевой терапии». Международный журнал радиационной онкологии, биологии, физики. 8 (12): 2199–205. Дои:10.1016/0360-3016(82)90570-3. PMID 6298160.
- ^ Fabrikant, JL; Франкель, К.А.; Филлипс, MH; Lyman, JT; Леви, Р.П. (1989). «Стереотаксическая пиковая радиохирургия BRagg с тяжелыми заряженными частицами для лечения внутричерепных артериовенозных мальформаций». В Эдвардсе, MSB; Хоффман, HJ (ред.). Заболевания сосудов головного мозга в детском и подростковом возрасте. Балтимор, Мэриленд: Уильямс и Уилкинс. С. 389–409.
- ^ Fabrikant, JI; Lyman, JT; Франкель, К.А. (1985). "Радиохирургия пика Брэгга тяжелых заряженных частиц при внутричерепных сосудистых заболеваниях". Радиационные исследования. 8 (Прил.): S244 – S258. Bibcode:1985РадР..104С.244Ф. Дои:10.2307/3576654. JSTOR 3576654. PMID 3937172.
- ^ Fabrikant, JI; Lyman, JT; Хособути, Y (июнь 1984 г.). «Стереотаксическая тяжелая ионная радиохирургия пика Брэгга при внутричерепных сосудистых нарушениях: метод лечения глубоких артериовенозных мальформаций». Британский журнал радиологии. 57 (678): 479–90. Дои:10.1259/0007-1285-57-678-479. PMID 6426570.
- ^ Kjellberg, RN; Ханамура, Т; Дэвис, КР; Лайонс, SL; Адамс, Р. Д. (4 августа 1983 г.). «Протонно-лучевая терапия брэгговского пика при артериовенозных мальформациях головного мозга». Медицинский журнал Новой Англии. 309 (5): 269–74. Дои:10.1056 / NEJM198308043090503. PMID 6306463.
- ^ Леви, РП; Fabrikant, JI; Франкель, К.А.; Филлипс, MH; Лайман, JT (июнь 1989 г.). «Стереотаксическая радиохирургия пика Брэгга с тяжелыми заряженными частицами для лечения внутричерепных артериовенозных мальформаций в детстве и подростковом возрасте». Нейрохирургия. 24 (6): 841–52. Дои:10.1097/00006123-198906000-00009. PMID 2664546.
- ^ Steinberg, Gary K .; Fabrikant, Jacob I .; Маркс, Майкл П .; Леви, Ричард П .; Frankel, Kenneth A .; Филлипс, Марк Х .; Шуер, Лоуренс М .; Сильверберг, Джеральд Д. (12 июля 1990 г.). «Стереотаксическое излучение брэгговского пика с тяжелыми заряженными частицами для внутричерепных артериовенозных мальформаций». Медицинский журнал Новой Англии. 323 (2): 96–101. Дои:10.1056 / NEJM199007123230205. PMID 2359429.
- ^ Гольдберг, ИД; Bloomer, WD; Доусон, DM (12 марта 1982 г.). «Токсическое действие противораковой терапии на нервную систему». JAMA: журнал Американской медицинской ассоциации. 247 (10): 1437–41. Дои:10.1001 / jama.1982.03320350041026. PMID 7057532.
- ^ Keime-Guibert, F; Наполитано, М; Делаттр, JY (ноябрь 1998 г.). «Неврологические осложнения лучевой терапии и химиотерапии». Журнал неврологии. 245 (11): 695–708. Дои:10.1007 / s004150050271. PMID 9808237. S2CID 3027021.
- ^ ТОБИАС, Калифорния; ГНЕВ, HO; ЛОУРЕНС, JH (январь 1952 г.). «Радиологическое использование дейтронов высоких энергий и альфа-частиц». Американский журнал рентгенологии, радиевой терапии и ядерной медицины. 67 (1): 1–27. PMID 14903252.
- ^ Пинский, Л. С .; Osborne, W. Z .; Bailey, J. V .; Benson, R.E .; Томпсон, Л. Ф. (8 марта 1974 г.). «Вспышки света, наблюдаемые астронавтами с Аполлона 11 - Аполлона 17». Наука. 183 (4128): 957–959. Bibcode:1974Научный ... 183..957P. Дои:10.1126 / science.183.4128.957. PMID 17756755. S2CID 43917453.
- ^ Sannita, WG; Acquaviva, M; Ball, SL; Belli, F; Bisti, S; Бидоли, В; Кароццо, S; Казолино, М; Cucinotta, F; Де Паскаль, депутат; Ди Фино, L; Ди Марко, S; Maccarone, R; Мартелло, К; Миллер, Дж; Narici, L; Пичи, NS; Picozza, P; Ринальди, А; Ruggieri, D; Сатурно, М; Schardt, D; Васкес, М. (2004). «Влияние тяжелых ионов на зрительную функцию и электрофизиологию грызунов: проект ALTEA-MICE». Успехи в космических исследованиях. 33 (8): 1347–51. Bibcode:2004AdSpR..33.1347S. Дои:10.1016 / j.asr.2003.11.007. PMID 15803626.
- ^ Reinhold, H. S .; Хопуэлл, Дж. У. (1 июля 1980 г.). «Поздние изменения архитектуры кровеносных сосудов мозга крысы после облучения». Британский журнал радиологии. 53 (631): 693–696. Дои:10.1259/0007-1285-53-631-693. PMID 7426892.
- ^ Сквайр, Л. Р. (апрель 1992 г.). «Память и гиппокамп: синтез результатов с крысами, обезьянами и людьми». Психологический обзор. 99 (2): 195–231. Дои:10.1037 / 0033-295X.99.2.195. PMID 1594723. S2CID 14104324.
- ^ Эйш, AJ (2002). «Взрослый нейрогенез: значение для психиатрии». Пластичность мозга взрослого: от генов к нейротерапии. Прогресс в исследованиях мозга. 216. С. 301–326. CiteSeerX 10.1.1.459.6669. Дои:10.1016 / S0079-6123 (02) 38085-3. ISBN 9780444509819. PMID 12432777.
- ^ а б Мизумацу, S; Monje, ML; Morhardt, DR; Рола, Р; Палмер, Т.Д .; Файк, младший (15 июля 2003 г.). «Чрезвычайная чувствительность взрослого нейрогенеза к низким дозам рентгеновского излучения». Исследования рака. 63 (14): 4021–7. PMID 12874001.
- ^ Monje, ML; Мизумацу, S; Файк, младший; Палмер, Т. Д. (сентябрь 2002 г.). «Облучение вызывает дисфункцию нервных клеток-предшественников». Природа Медицина. 8 (9): 955–62. Дои:10,1038 / нм 749. PMID 12161748. S2CID 10347561.
- ^ а б Casadesus, G; Шукитт-Хейл, B; Кантути-Кастельветри, I; Рабин, БМ; Джозеф, Дж. А. (2004). «Влияние облучения тяжелыми частицами на разведку и реакцию на изменение окружающей среды». Успехи в космических исследованиях. 33 (8): 1340–6. Bibcode:2004AdSpR..33.1340C. Дои:10.1016 / j.asr.2003.12.011. PMID 15803625.
- ^ а б c d Casadesus, G; Шукитт-Хейл, B; Stellwagen, HM; Смит, Массачусетс; Рабин, БМ; Джозеф, Дж. А. (март 2005 г.). «Нейрогенез в гиппокампе и экспрессия PSA-NCAM после воздействия частиц 56Fe имитирует то, что наблюдается во время старения у крыс». Экспериментальная геронтология. 40 (3): 249–54. Дои:10.1016 / j.exger.2004.09.007. PMID 15763403. S2CID 12158885.
- ^ Рола, Р; Оцука, S; Обенаус, А; Нельсон, Джорджия; Лимоли, CL; VandenBerg, SR; Файк, младший (октябрь 2004 г.). «Показатели нейрогенеза гиппокампа изменяются при облучении частицами 56Fe дозозависимым образом». Радиационные исследования. 162 (4): 442–6. Bibcode:2004РадР..162..442Р. Дои:10.1667 / RR3234. PMID 15447038. S2CID 28785536.
- ^ а б Рола, Р; Саркисян, В; Обенаус, А; Нельсон, Джорджия; Оцука, S; Лимоли, CL; Фике, младший (октябрь 2005 г.). «Излучение с высокой ЛПЭ вызывает воспаление и стойкие изменения маркеров нейрогенеза гиппокампа». Радиационные исследования. 164 (4, п. 2): 556–60. Bibcode:2005RadR..164..556R. Дои:10.1667 / RR3412.1. PMID 16187787. S2CID 25220084.
- ^ Лимоли, CL; Giedzinski, E; Рола, Р; Оцука, S; Палмер, Т.Д .; Файк, младший (январь 2004 г.). «Радиационная реакция нервных клеток-предшественников: связь клеточной чувствительности с контрольными точками клеточного цикла, апоптозом и окислительным стрессом». Радиационные исследования. 161 (1): 17–27. Bibcode:2004РадР..161 ... 17л. Дои:10.1667 / RR3112. PMID 14680400. S2CID 5720838.
- ^ Giedzinski, E; Rola, R; Файк, младший; Лимоли, CL (октябрь 2005 г.). «Эффективное производство активных форм кислорода в нервных клетках-предшественниках после воздействия протонов 250 МэВ». Радиационные исследования. 164 (4 Pt 2): 540–4. Bibcode:2005РадР..164..540Г. Дои:10.1667 / rr3369.1. PMID 16187784. S2CID 25794276.
- ^ Лимоли, CL; Giedzinski, E; Бауре, Дж; Рола, Р; Файк, младший (июнь 2007 г.). «Редокс-изменения, вызванные в клетках-предшественниках гиппокампа облучением тяжелыми ионами». Радиационная и экологическая биофизика. 46 (2): 167–72. Дои:10.1007 / s00411-006-0077-9. PMID 17103219. S2CID 9727094.
- ^ Кирканиды, S; Мур, AH; Olschowka, JA; Daeschner, JC; Уильямс, JP; Hansen, JT; Керри О'Бэнион, М. (15 августа 2002 г.). «Циклооксигеназа-2 модулирует экспрессию генов, связанных с воспалением мозга, при лучевом поражении центральной нервной системы». Исследование мозга. Молекулярные исследования мозга. 104 (2): 159–69. Дои:10.1016 / S0169-328X (02) 00353-4. PMID 12225870.
- ^ Мур, AH; Olschowka, JA; Уильямс, JP; Окунев, П; О'Бэнион, МК (1 мая 2005 г.). «Регуляция синтеза простагландина E2 после облучения мозга». Международный журнал радиационной онкологии, биологии, физики. 62 (1): 267–72. Дои:10.1016 / j.ijrobp.2005.01.035. PMID 15850932.
- ^ Hwang, SY; Юнг, JS; Ким, TH; Lim, SJ; Ой, ES; Ким, JY; Ji, KA; Джо, EH; Чо, К.Х .; Хан, И.О. (март 2006 г.). «Ионизирующее излучение вызывает глиоз астроцитов за счет активации микроглии». Нейробиология болезней. 21 (3): 457–67. Дои:10.1016 / j.nbd.2005.08.006. PMID 16202616. S2CID 31123469.
- ^ Raber, J; Rola, R; ЛеФевур, А; Morhardt, D; Керли, Дж; Мизумацу, S; VandenBerg, SR; Файк, младший (июль 2004 г.). «Радиационно-индуцированные когнитивные нарушения связаны с изменением показателей нейрогенеза гиппокампа». Радиационные исследования. 162 (1): 39–47. Bibcode:2004РадР..162 ... 39Р. Дои:10.1667 / RR3206. PMID 15222778. S2CID 25568036.
- ^ Шукитт-Хейл, B; Casadesus, G; Кантути-Кастельветри, I; Рабин, БМ; Джозеф, Дж. А. (2003). «Когнитивный дефицит, вызванный радиационным воздействием 56Fe». Успехи в космических исследованиях. 31 (1): 119–26. Bibcode:2003AdSpR..31..119S. Дои:10.1016 / s0273-1177 (02) 00878-5. PMID 12577981.
- ^ а б Шукитт-Хейл, B; Casadesus, G; McEwen, JJ; Рабин, БМ; Джозеф, Дж. А. (июль 2000 г.). «Пространственное обучение и дефицит памяти, вызванный воздействием радиации с 56 частицами железа». Радиационные исследования. 154 (1): 28–33. Дои:10.1667 / 0033-7587 (2000) 154 [0028: SLAMDI] 2.0.CO; 2. PMID 10856962.
- ^ Joseph, JA; Хант, Вашингтон; Рабин, БМ; Далтон, Т.К. (апрель 1992 г.). «Возможное« ускоренное старение полосатого тела », вызванное облучением тяжелыми частицами 56Fe: последствия для пилотируемых космических полетов». Радиационные исследования. 130 (1): 88–93. Bibcode:1992РадР..130 ... 88J. Дои:10.2307/3578484. JSTOR 3578484. PMID 1561322.
- ^ Joseph, JA; Хант, Вашингтон; Рабин, БМ; Далтон, ТК; Харрис, AH (август 1993 г.). «Дефицит чувствительности мускариновых рецепторов полосатого тела, вызванный облучением тяжелыми частицами 56Fe: дальнейшие параллели« возраст-радиация »» (PDF). Радиационные исследования. 135 (2): 257–61. Bibcode:1993RadR..135..257J. Дои:10.2307/3578303. JSTOR 3578303. PMID 8367598.
- ^ Joseph, JA; Катлер, Р. К. (17 ноября 1994 г.). «Роль окислительного стресса в изменениях передачи сигнала и потере клеток при старении». Летопись Нью-Йоркской академии наук. 738 (1): 37–43. Bibcode:1994НЯСА.738 ... 37J. Дои:10.1111 / j.1749-6632.1994.tb21787.x. PMID 7832444.
- ^ Pecaut, MJ; Haerich, P; Миллер, CN; Смит, AL; Zendejas, ED; Нельсон, Джорджия (август 2004 г.). «Влияние низких доз облучения с высокой ЛПЭ на три модели поведения мышей C57BL / 6». Радиационные исследования. 162 (2): 148–56. Bibcode:2004РадР..162..148П. Дои:10.1667 / rr3205. PMID 15387142. S2CID 26525020.
- ^ Хант, Вашингтон; Joseph, JA; Рабин, Б.М. (1989). «Поведенческие и нейрохимические нарушения после воздействия низких доз высокоэнергетических частиц железа». Успехи в космических исследованиях. 9 (10): 333–6. Bibcode:1989AdSpR ... 9..333H. Дои:10.1016/0273-1177(89)90456-0. PMID 11537313.
- ^ а б Рабин, БМ; Хант, Вашингтон; Джозеф, Дж. А. (июль 1989 г.). «Оценка поведенческой токсичности частиц железа высокой энергии по сравнению с другими качествами излучения». Радиационные исследования. 119 (1): 113–22. Bibcode:1989РадР..119..113Р. Дои:10.2307/3577371. JSTOR 3577371. PMID 2756102.
- ^ а б c Рабин, БМ; Хант, Вашингтон; Joseph, JA; Далтон, ТК; Кандасами, С.Б. (ноябрь 1991 г.). «Связь между линейной передачей энергии и поведенческой токсичностью у крыс после воздействия протонов и тяжелых частиц». Радиационные исследования. 128 (2): 216–21. Bibcode:1991РадР..128..216Р. Дои:10.2307/3578141. JSTOR 3578141. PMID 1658847.
- ^ а б Рабин, БМ; Joseph, JA; Хант, Вашингтон; Далтон, ТБ; Kandasamy, SB; Harris, AH; Людвигт, Б. (октябрь 1994 г.). «Поведенческие конечные точки для лучевого поражения». Успехи в космических исследованиях. 14 (10): 457–66. Bibcode:1994AdSpR..14..457R. Дои:10.1016/0273-1177(94)90500-2. PMID 11539983.
- ^ Рабин, БМ; Joseph, JA; Шукитт-Хейл, B; МакИвен, Дж (2000). «Влияние воздействия тяжелых частиц на поведение, опосредованное дофаминергической системой». Успехи в космических исследованиях. 25 (10): 2065–74. Bibcode:2000AdSpR..25.2065R. Дои:10.1016 / s0273-1177 (99) 01014-5. PMID 11542858.
- ^ РАЙЛИ, ЭНТОНИ Л .; ТАК, ДИАНА Л. (1 июня 1985 г.). «Обусловленное отвращение к вкусу: поведенческий индекс токсичности». Летопись Нью-Йоркской академии наук. 443 (1 экспериментальный): 272–292. Bibcode:1985НЯСА.443..272Р. Дои:10.1111 / j.1749-6632.1985.tb27079.x. PMID 2990284.
- ^ а б c Рабин, БМ; Шукитт-Хейл, B; Joseph, JA; Carrihill-Knoll, KL; Кэри, АН; Ченг, В. (июнь 2007 г.). «Относительная эффективность различных частиц и энергий в нарушении поведенческих характеристик». Радиационная и экологическая биофизика. 46 (2): 173–7. Дои:10.1007 / s00411-006-0071-2. PMID 17058092. S2CID 21525732.
- ^ Рабин, БМ; Joseph, JA; Шукитт-Хейл, Б. (2003). «Долгосрочные изменения в подкреплении, вызванном амфетамином, и отвращении у крыс после воздействия частицы 56Fe». Успехи в космических исследованиях. 31 (1): 127–33. Bibcode:2003AdSpR..31..127R. Дои:10.1016 / s0273-1177 (02) 00879-7. PMID 12577984.
- ^ а б c Рабин, БМ; Joseph, JA; Шукитт-Хейл, Б. (2 марта 2005 г.). «Влияние возраста и диеты на вызванное тяжелыми частицами нарушение оперантной реакции, вызванное наземной моделью воздействия космических лучей». Исследование мозга. 1036 (1–2): 122–9. Дои:10.1016 / j.brainres.2004.12.041. PMID 15725409. S2CID 24700643.
- ^ а б Денисова Н.А. Шукитт-Хейл, B; Рабин, БМ; Джозеф, Дж. А. (декабрь 2002 г.). «Передача сигналов в мозгу и поведенческие реакции, вызванные воздействием радиации (56) Fe-частиц». Радиационные исследования. 158 (6): 725–34. Дои:10.1667 / 0033-7587 (2002) 158 [0725: bsabri] 2.0.co; 2. JSTOR 3580733. PMID 12452775.
- ^ Фахаро, LF; Бертонг, М; Андерсон, RE (2001). Лучевая патология. Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0195110234.
- ^ а б Эдельштейн-кешет, Л; Спирос, А. (7 июня 2002 г.). «Изучение образования сенильных бляшек при болезни Альцгеймера in silico» (PDF). Журнал теоретической биологии. 216 (3): 301–26. Дои:10.1006 / jtbi.2002.2540. PMID 12183120.
- ^ Катания, А; Городской, S; Ян, Э; Hao, C; Barron, G; Аллалунис-Тернер, Дж. (Апрель 2001 г.). «Экспрессия и локализация циклин-зависимой киназы 5 в апоптотических клетках глиомы человека» (PDF). Нейроонкология. 3 (2): 89–98. Дои:10.1215/15228517-3-2-89. ЧВК 1920606. PMID 11296485.
- ^ Muyllaert, D; Terwel, D; Кремер, А; Сеннвик, К; Borghgraef, P; Девиджвер, H; Dewachter, I; Ван Левен, Ф (февраль 2008 г.). «Нейродегенерация и нейровоспаление у cdk5 / p25-индуцибельных мышей: модель склероза гиппокампа и неокортикальной дегенерации». Американский журнал патологии. 172 (2): 470–85. Дои:10.2353 / ajpath.2008.070693. ЧВК 2312368. PMID 18202185.
- ^ Cruz, JC; Ценг, ХК; Goldman, JA; Ши, H; Цай, Л.Х. (30 октября 2003 г.). «Аберрантная активация Cdk5 с помощью p25 запускает патологические события, ведущие к нейродегенерации и нейрофибриллярным клубкам». Нейрон. 40 (3): 471–83. Дои:10.1016 / s0896-6273 (03) 00627-5. PMID 14642273. S2CID 10549030.
- ^ Durante, M; Кучинотта, ФА (июнь 2008 г.). «Канцерогенез тяжелых ионов и освоение космоса человеком». Обзоры природы Рак. 8 (6): 465–72. Дои:10.1038 / nrc2391. HDL:2060/20080012531. PMID 18451812. S2CID 8394210.
- ^ Барселлос-Хофф, штат Миннесота; Парк, Ц; Райт, EG (ноябрь 2005 г.). «Радиация и микросреда - онкогенез и терапия». Обзоры природы Рак. 5 (11): 867–75. Дои:10.1038 / nrc1735. PMID 16327765. S2CID 27710571.
- ^ Bjelakovic, G; Николова, Д; Gluud, LL; Simonetti, RG; Глууд, К. (28 февраля 2007 г.). «Смертность в рандомизированных исследованиях антиоксидантных добавок для первичной и вторичной профилактики: систематический обзор и метаанализ». JAMA: журнал Американской медицинской ассоциации. 297 (8): 842–57. Дои:10.1001 / jama.297.8.842. PMID 17327526.
- ^ Raber, J; Вонг, Д; Буттини, М; Орт, М; Беллоста, С; Pitas, RE; Мэли, RW; Mucke, L (1 сентября 1998 г.). «Изоформ-специфические эффекты человеческого аполипопротеина E на функцию мозга, выявленные у мышей с нокаутом ApoE: повышенная восприимчивость самок». Труды Национальной академии наук Соединенных Штатов Америки. 95 (18): 10914–9. Bibcode:1998PNAS ... 9510914R. Дои:10.1073 / пнас.95.18.10914. ЧВК 27995. PMID 9724804.
внешняя ссылка
![]() Эта статья включаетматериалы общественного достояния от Национальное управление по аэронавтике и исследованию космического пространства документ: «Здоровье человека и риски при выполнении космических миссий» (PDF). (НАСА SP-2009-3405)
Эта статья включаетматериалы общественного достояния от Национальное управление по аэронавтике и исследованию космического пространства документ: «Здоровье человека и риски при выполнении космических миссий» (PDF). (НАСА SP-2009-3405)
